根据药渡数据调研,本次统计周期(2024.04.06-04.12)无新增新注册分类首家过评受理号。与上次统计周期相比,本次减少1个新注册分类首家过评品种。
根据药渡数据调研,本次统计周期(2024.04.06-04.12)无新增一致性评价首家过评受理号。与上次统计周期相比,本次减少1个一致性评价首家过评品种。
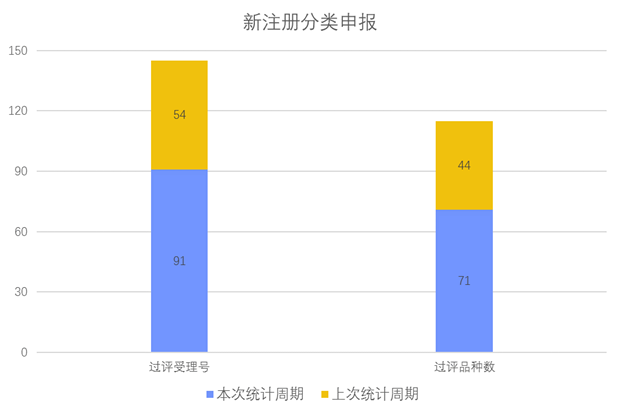
根据药渡数据调研,本次统计周期(2024.04.06-04.12)新注册分类新增2个过评受理号,涉及2个品种,包含1个片剂,1个胶囊剂。与上次统计周期相比,本次减少17个新注册分类过评品种。

根据药渡数据调研,本次统计周期(2024.04.06-04.12)一致性评价新增9个过评受理号,涉及8个品种,包括2个胶囊剂,5个片剂,1个注射剂。与上次统计周期相比,本次减少2个一致性评价过评品种。
醋酸钠林格注射液,1978年由国外药企推出,临床上大多数都用在补充体液,调节电解质平衡、纠正酸中毒,临床应用科室有麻 醉科、ICU、急诊科、大外科、烧伤科等。相较于生理盐水和其他林格液,醋酸钠林格液中醋酸的代谢对肝的依赖性较小。除肝代谢主途径外,少量醋酸根还可以在肾、心脏和肌肉细胞内直接转化为乙酰辅酶A、进入三羧酸循环,产生二氧化碳和水,非常适合于休克和肝功能障碍甚至衰竭等危重情况的患者。
根据药渡数据-仿制药库调研,目前共有10家企业拥有醋酸钠林格注射液的生产批文,涉及企业有:石药银湖制药、浙江莎普爱思药业、湖北多瑞药业、科伦药业、石家庄四药等。

篇幅原因,仅展示前五家企业申报进展情况,更多信息,请查看药渡数据-仿制药库
根据药渡数据调研,国内醋酸钠林格注射液的申报格局为“6+7”,过评格局为“5+6”。根据药渡数据-一致性评价库调研,河北仁合益康药业递交的新3类仿制申请于2022年11月视同过评,成为该品种的“首家”过评企业;仿制药巨头科伦药业和石家庄四药2家企业于去年5月4日同日过评。
药渡数据-中国注册库统计信息数据显示,目前尚有浙江莎普爱思药业于2023年1月递交了该品种的一致性评价补充申请,同年11月浙江康吉尔药业递交了醋酸钠林格注射液的新3类报产申请,上述2个申请正在审评审批中。

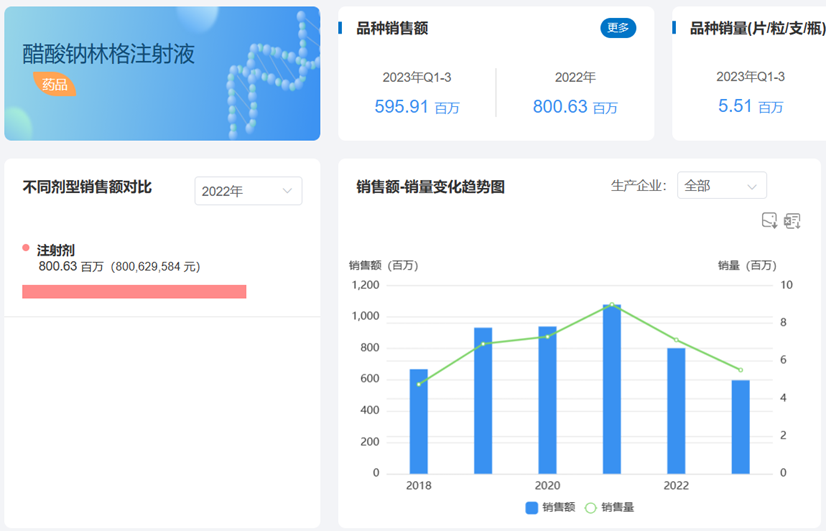
根据药渡数据-中国销量库调研,醋酸钠林格注射液2018-2022年销量总体呈持续增长态势,2021年创出销售新高,当年销售总额超过10亿元,成为当之无愧的大品种,2022全年销售虽有下滑,但仍保持住8亿元大关。2017年之前,多瑞药业独占该品种销售市场,2018年石家庄四药、科伦药业和石药银湖的醋酸钠林格注射液相继上市以后,市场格局才稍微发生一点变化。即便高手云集,多瑞药业仍然稳坐“王 者”宝座,2022年市场占比高达86.88%。此次石药银湖通过审评,市场寡头又多一名强劲的对手,未来市场之间的竞争格局将如何变化,药渡将持续关注。
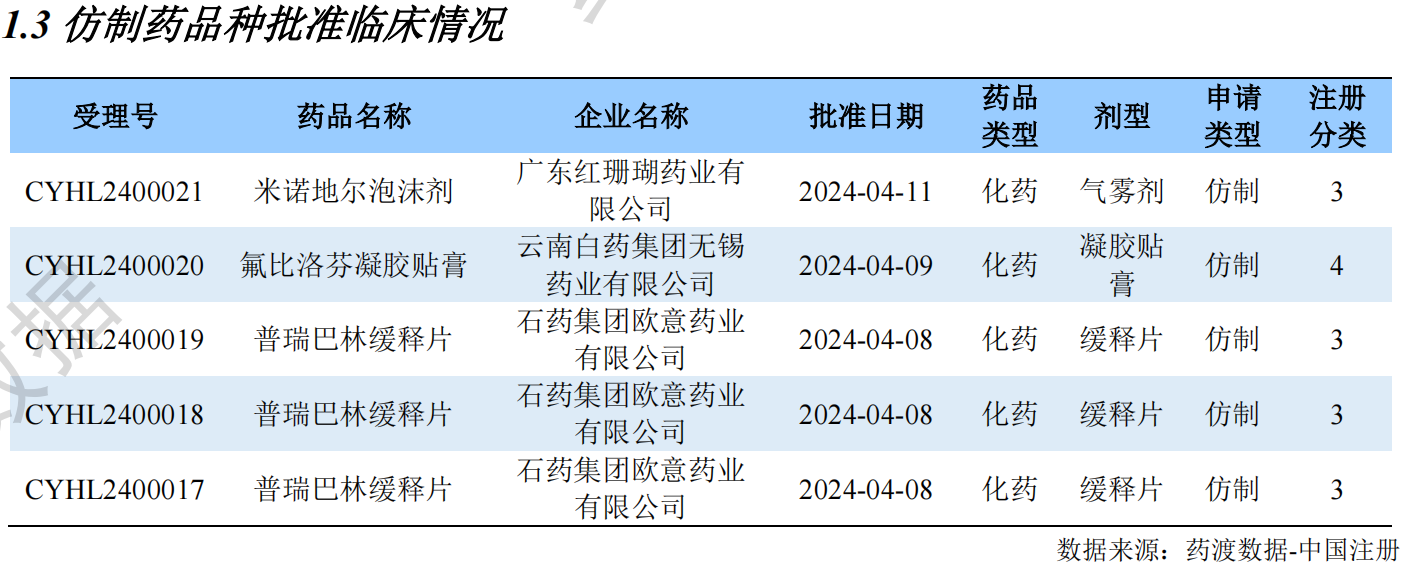
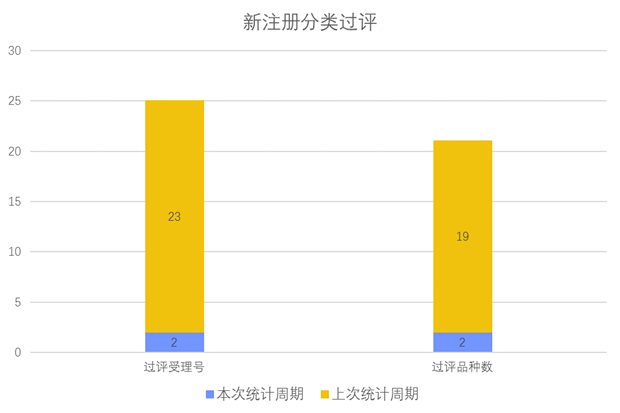
根据药渡数据调研,本次统计周期(2024.04.06-04.12)新注册分类数据新增91个新报受理号,涉及71个品种,包括1个鼻用喷雾剂,1个搽剂,1个滴剂,1个滴眼剂,1个灌肠剂,2个混悬液,5个胶囊剂,2个颗粒剂,4个口服溶液剂,1个口服乳剂,1个口服散剂,2个凝胶贴膏,18个片剂,1个气雾剂,2个乳膏剂,1个散剂, 1个贴剂,1个吸入溶液剂,25个注射剂。与上次统计周期相比,本次增加27个新注册分类申报品种。
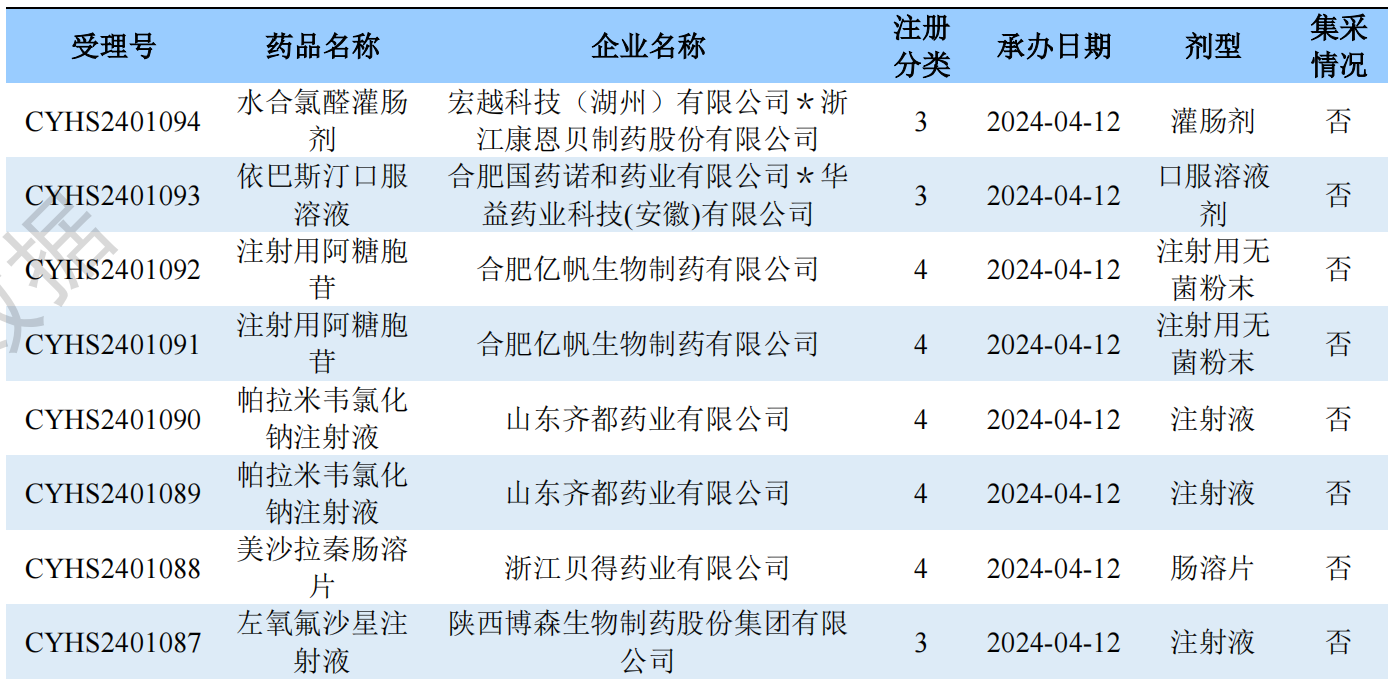
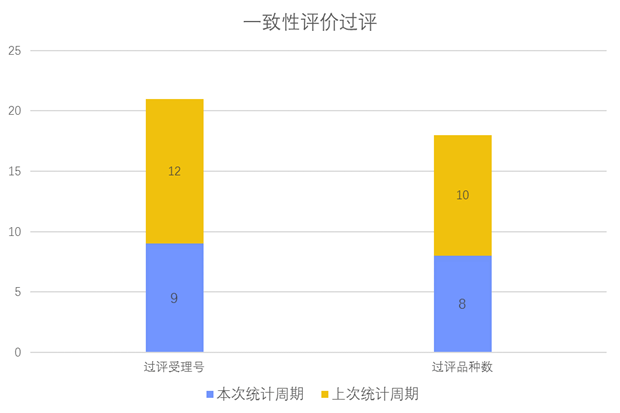
根据药渡数据调研,本次统计周期(2024.04.06-04.12)一致性评价数据新增21个新报受理号,涉及13个品种,包括1个胶囊剂,1个干混悬剂,2个片剂,9个注射剂。与上次统计周期相比,本次增加7个一致性评价申报品种。
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对羟苯磺酸钙口服制剂(包括羟苯磺酸钙胶囊、羟苯磺酸钙片、羟苯磺酸钙分散片、羟苯磺酸钙颗粒)说明书内容做统一修订。现将有关事项公告如下:
一、上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关法律法规,按照附件要求修订说明书,于2024年6月30日前报国家药监管理局药品审评中心或省级药品监督管理部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得接着使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
二、药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取比较有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
三、临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应该依据新修订说明书进行充分的获益/风险分析。
四、患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。
五、省级药监管理部门应当督促行政区域内上述药品的上市许可持有人按要求做好相应说明书修订和标签、说明书更换工作,对违反法律法规行为依法严厉查处。特此公告。
2024年4月9日,福安药业(集团)股份有限公司发布了重要的公告称,公司于近日收到国家药品监督管理局签发的化学原料药上市申请批准通知书。现将详细情况公告如下:
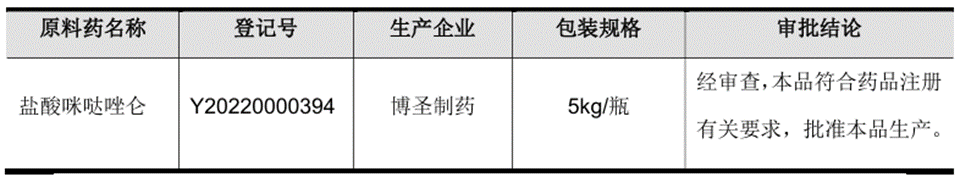
盐酸咪哒制剂产品大多数都用在麻 醉前给药、全麻 醉诱导和维持、椎管内麻 醉及局部麻 醉时辅助用药、诊断或治疗性操作(如心血管造影、心律转复、支气管镜检查、消化道内镜检查等)时病人镇静、ICU 病人镇静。根据国家药品监督管理局信息平台查询显示:截至目前,盐酸咪达 原料药获得上市申请批准的有2 家企业(含博圣制药)。上述原料药产品获得上市批准将可以在国内上市制剂中使用,进一步丰富了子公司产品线。


